의료 2020년 의약품 제조.품질관리 기준 주요 개선사항 안내
페이지 정보
작성자휴먼아카데미 댓글 0건 작성일 20-12-09 11:56본문
2020년 의약품 제조·품질관리 기준 주요 개선사항 안내 「의약품 GMP 제도 개선사항 관련 질의·답변집」 발간 |
□ 식품의약품안전처는 올해 추진한 의약품 제조 및 품질관리기준(GMP)에 관한 국제조화 내용과 코로나19 확산에 따른 평가방법 개편사항 등을 종합한 안내서를 발간합니다.
※ 의약품 제조 및 품질관리 기준(GMP) : 품질이 보증된 의약품을 제조하기 위한 전 공정에 걸친 제조 및 품질관리에 관한 조직적이고 체계적인 규정
○ 이번 안내서는 올해 2월부터 10월까지 시행한 주요 제도 개선사항을 제약 현장에서 원활하게 적용할 수 있도록 마련하였으며, 업계의 이해도를 높이기 위해 그간의 주요 질의, 답변 내용을 추가하였습니다.
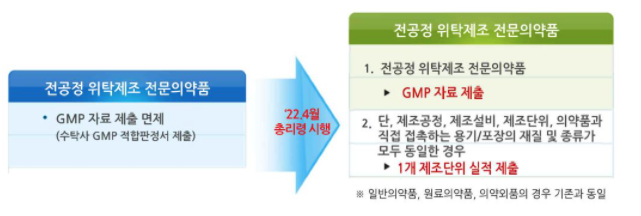
○ 주요 내용은 ▲ 동일한 제조 공정으로 위탁 생산하는 전문 의약품에 대한 자료제출 요건 강화 ▲ 전주기 관리를 위한 '의약품 품질 시스템' 도입 ▲ 의약품 허가신청 자료 및 품질 관리의 신뢰성 향상을 위한 '의약품 제조, 수입업체 데이터 완전성 평가지침' 마련 ▲ 코로나19 확산 및 장기화에 따라 단계쩍응로 시행하는 수입 의약품 GMP평가 개편사항 등입니다.
□ 식약처는 앞으로도 국내 제약업계에서 국제적 수준의 제조 및 품질관리기준(GMP)을 도입, 활용하도록 하여 보다 우수한 품질의 의약품을 국민께 공급하기 위해 노력하겠다고 밝혔습니다.
○ 자세한 내용은 식약처 대표 누리집(mfds.go.kr) → 정책정보 → 의약품정책정보 → 제조품질관리기준(GMP)에서 확인할 수 있습니다.
출처: 식약처
사진출처: 식약처
댓글목록
등록된 댓글이 없습니다.